Teilprojekte
Die Teilprojekte des SFB 1066 setzen sich aus den Projekten der Teilbereiche A und B sowie den Querschnittsprojekten (Q) und den zentralen Projekten (Z) zusammen.
Im Teilbereich A werden von der chemischen Seite her sehr unterschiedliche Träger zur Verfügung gestellt, wobei sowohl komplexe kovalent verknüpfte Polymerarchitekturen als auch selbstorganisierende Strukturen berücksichtigt werden.
Das Projekt kombiniert polysaccharidische Materialien zur Herstellung nanodimensionaler Partikel und Kapselstrukturen mit der Synthese und Anbindung komplexer Oligosaccharide zur gezielten Adressierung von Immunzellen. Durch polysaccharidische Nanokapseln mit hoher Verkapselungseffizienz, langer Blutzirkulation und kontrollierbarer Oberflächenfunktionalität sollen Trägersysteme zur Adressierung verschiedener Immunzellpopulationen hergestellt werden, deren Hülle durch lokale Stimuli abgebaut wird und die eingeschlossenen Wirkstoffe lokal freisetzt.
T. Opatz, K. Landfester
Projektrelevante Publikationen seit 2017:
Krumb M§, Frey ML§, Langhanki J, Forster R, Kowalczyk D, Mailänder V, Landfester K,
Krumb M, Jäger M, Voss A, Immig L, Peters K, Kowalczyk D, Bufe A, Opatz T*, Holst O, Vogel C, Peters M*. Total Synthesis of a Partial Structure from Arabinogalactan and its Application for Allergy-Prevention. (2020) Chem. Eur. J.
Wagener K, Bros M, Krumb M, Langhanki J, Pektor S, Worm M, Schinnerer M, Montermann E, Miederer M, Frey H, Opatz T, Rösch F. Targeting of Immunce Cells with Trimannosylated Liposomes. (2020) Adv. Ther. 1900185.
Tabujew I, Willig M, Leber N, Freidel C, Negwer I, Koynov K, Helm M, Landfester K, Zentel R, Peneva K, Mailänder V. Overcoming the barrier of CD8(+) T cells: Two types of nano-sized carriers for siRNA transport. (2019) Acta Biomater. 100:338-351.
Krumb M, Kammer LM, Forster R, Grundke C, Opatz T*. Visible Light-Induced Cleavage of C–S bonds in Thioacetals and Thioketals with Iodine as a Photocatalyst. (2019) ChemPhotoChem. 4:101-104. (Very Important Paper and Front Cover)
Simon J, Bauer KN, Langhanki J, Opatz T, Mailänder V, Landfester K, Wurm FR. Noncovalent Targeting of Nanocarriers to Immune Cells with Polyphosphoester-Based Surfactants in Human Blood Plasma. (2019) Adv. Sci. 6:1901199.
Kramer S, Langhanki J, Krumb M, Opatz T, Bros M, Zentel R*. HPMA-Based Nanocarriers for Effective Immune System Stimulation. (2019) Macromol. Biosci. 1800481.
Schlegel I, Renz P, Simon J, Lieberwirth I, Pektor S, Bausbacher N, Miederer M, Mailänder V, Munoz-Espi R, Crespy D, Landfester K. Highly Loaded Semipermeable Nanocapsules for Magnetic Resonance Imaging. (2018) Macromol. Biosci. 18(4):e1700387.
Krumb M, Lucas T, Opatz T*. Visible Light Enables Aerobic Iodine Catalyzed Glycosylation. (2019) Eur. J. Org. Chem. 4517-4521. (Front Cover)
Simon J, Christmann S, Mailänder V, Wurm FR, Landfester K. Protein Corona Mediated Stealth Properties of Biocompatible Carbohydrate-based Nanocarriers. (2018) Isr. J. Chem. 58:1363-1372
Dieses Teilprojekt hat das Ziel die Morphologie und Funktion von peptidischen Trägermaterialien präzise zu kontrollieren, um damit den Einfluss von Form, Größe und Funktion von Nanopartikeln auf die Modulation des Immunsystems zu untersuchen. Die präzise Kontrolle von Morphologie und Funktion soll durch die Kombination natürlicher Proteine, mit lebender Ringöffnungspolymerisation und chemoselektiver Biokonjugation erreicht werden. Hierdurch sollen peptidbasierte Trägersysteme hergestellt werden, die es erlauben den Einfluss von Morphologie und Funktion auf eine Immunmodulation im Detail zu untersuchen.
M. Barz, T. Weil
Projektrelevante Publikationen seit 2017:
Chen C, Ng DYW, Weil T. Polymer bioconjugates: Modern design concepts toward precision hybrid materials. (2020) Progr. Polym. Sci. 101241.
Alberg I, Kramer S, Schinnerer M, Seidl C, Drude N, Lammers T, Tenzer S, M Barz, R. Zentel. Polymeric Nanoparticles with Neglectable Protein Corona. (2020) Small 16(18):1907574.
Sun Q, Barz M, De Geest BG, Diken M, Kiessling F, Lammers T, Shi Y. Nanomedi-cine and macroscale materials in immuno-oncology. (2019) Chem. Soc. Rev. 48(1):351-381.
Alkilany AM, Weller H, Mews A, Parak WJ, Barz M, Feliu N. Ligand density on nanoparticles: A parameter with critical impact on nanomedicine. (2019) Adv. Drug Deliv. Rev. 143:22-36.
Chen C, Wunderlich K, Mukherji D, Koynov K, Heck AJ, Raabe M, Barz M, Fytas G, Kremer K, Ng DYW, Weil T. Precision anisotropic brush polymers by sequence controlled chemistry. (2019) J. Am. Chem. Soc. 142(3):1332-1340.
Negwer I, Best A, Schinnerer M, Schäfer O, Capeloa L, Wagner M, Schmidt M, Mailänder V, Barz M, Butt HJ, Koynov K. Monitoring drug nanocarriers in human blood by near-infrared fluorescence correlation spectroscopy. (2018) Nat Commun. 9(1):5306.
Morsbach S, Gonella G, Mailander V, Wegner S, Weidner T, Berger R, Koynov K, Vollmer D, Encinas N, Kuan SL, Kremer K, Weil T, Bonn M, Butt HJ, Landfester K. Engineering Proteins at Interfaces: From Complementary Characterization to Material Surfaces with Designed Functions. (2018) Angew. Chem. Internat. Ed. 57(39):12626-12648.
Agrawalla BK, Wang T, Riegger A, Domogalla MP, Steinbrink K, Dörfler T, Chen X, Boldt F, Michaelis J, Kuan SL, Weil T. Chemoselective Dual Labeling of Native and Recombinant Proteins. (2018) Bioconjug. Chem. 29(1):29-34.
Kuan SL, Wang T, Weil T. Site-Selective Disulfide Modification of Proteins – Expanding Diversity beyond the Proteome. (2016) Chem. Europ. J.
Hörtz C, Birke A, Kaps L, Decker S, Wächtersbach E, Fischer K, Schuppan D, Barz M, Schmidt M. Cylindrical Brush Polymers with Polypept(o)ide Side Chains: A Novel Biocompatible Carrier for Biomedical Applications. (2015) Macromolecules 48(7):2074-2086.
Hier werden Polymersome und Liposome als Carrier für RNA, Peptide und niedermolekulare Pharmaka entwickelt, die mit Targeting Strukturen und mit hyperverzweigtem PEG funktionalisiert werden können. Der Fokus liegt dabei darauf, die Stabilität dieser Strukturen chemisch verändern zu können, z.Bsp. durch Vernetzung oder Spaltung in leicht saurem Milieu. Hinzu kommt die Trägersystem-Optimierung in Bezug auf deren Herstellung und Formulierung.
H. Frey, M. Helm, R. Zentel
Projektrelevante Publikationen seit 2017:
Wagener K, Bros M, Krumb M, Langhanki J, Pektor S, Worm M, Schinnerer M, Montermann E, Miederer M, Frey H, Opatz T, Rösch F. Targeting of Immune Cells with Trimannosylated Liposomes. (2020) Adv. Therap. 3:1900185.
Weber C, Voigt M, Simon J, Danner AK, Frey H, Mailänder V, Helm M, Morsbach S, Landfester K. Functionalization of Liposomes with Hydrophilic Polymers Results in Macrophage Uptake Independent of the Protein Corona. (2019) Biomacromolecules. 20(8):2989-2999.
Danner AK, Schöttler S, Alexandrino E, Hammer S, Landfester K, Mailänder V, Morsbach S, Frey H, Wurm FR. Phosphonylation Controls the Protein Corona of Multifunctional Polyglycerol Modified Nanocarriers. (2019) Macromol Biosci. 19(5):1800468.
Pannwitt S, Slama K, Depoix F, Helm M, Schneider D. Against expectations: Unassisted RNA adsorption onto negatively charged lipid bilayers. (2019) Langmuir. 35(45):14704-14711.
Negwer I, Best A, Schinnerer M, Schäfer O, Capeloa L, Wagner M, Schmidt M, Mailänder V, Helm M, Barz M, Butt H-J, Koynov K. Monitoring drug nanocarriers in human blood by near-infrared fluorescence correlation spectroscopy. (2018) Nature Communications. 9(1):5306.
Wagener K, Worm M, Pektor S, Schinnerer M, Thiermann R, Miederer M, Frey H, Rösch F. Comparison of Linear and Hyperbranched Polyether Lipids for Liposome Shielding by 18F-Radiolabeling and Positron Emission Tomography. (2018) Biomacromolecules. 19:2506.
Hellmuth I, Freund I, Schlöder J, Seidu-Larry S, Thüring K, Slama K, Langhanki J, Kaloyanova S, Eigenbrod T, Krumb M, Röhm S, Peneva K, Opatz T, Jonuleit H, Dalpke AH, Helm M. Bioconjugation of Small Molecules to RNA Impedes Its Recognition by Toll-Like Receptor. (2017) Fronti. Immunol. 8:312.
Bartneck M, Schlößer C, Barz M, Zentel R, Trautwein C, Lammers T, Tacke F. Immunomodulatory Therapy of Inflammatory Liver Disease Using Selectin-Binding Glycopolymers. (2017) ACS Nano. 11:9689-9700.
Kramer S, Kim KO, Zentel R. Size Tunable Core Crosslinked Micelles from HPMA Based Amphiphilic Block Copolymers. (2017) Macromol. Chem. Phys. 218:1700113.
Scherer M, Kappel C, Mohr N, Fischer K, Heller P, Forst R, Depoix F, Bros M, Zentel R. Functionalization of Active Ester-Based Polymersomes for Enhanced Cell Uptake and Stimuli-Responsive Cargo Release. (2016) Biomacromolecules. 17:3305-3317.
Die Querschnitts-Projekte (Q) bilden die natürliche Brücke zwischen den A- und B-Projekten. Sie sind von zentraler Bedeutung für den Großteil der Teilprojekte im A- und B-Bereich und zeichnen sich durch einen sehr hohen SFB-spezifischen Forschungsanteil aus.
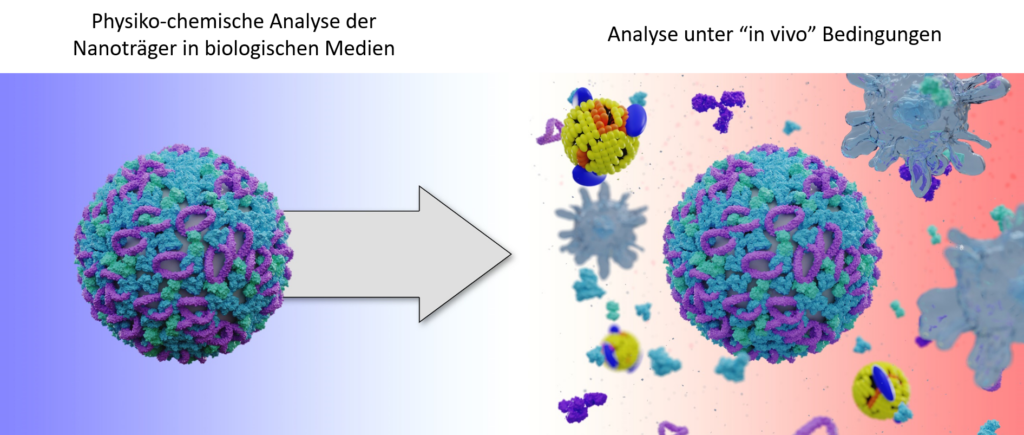
TP Q1 zielt auf die Wechselwirkung der Nanocarrier mit Blutbestandteilen ab. Hauptziel ist dabei die Bestimmung von molekularen Determinanten, die die Effizienz der in vivo-Aufnahme typischer im SFB untersuchter Polymer- und Lipid-basierten NP erhöhen können. Ein Schwerpunkt liegt auf der Untersuchung des Einflusses der Proteinkorona, der Protein-Lipid- Wechselwirkungen, und der Rolle der Lipide mit Hilfe von physikochemischer Charakterisierung, Computersimulationen und datengetriebener Modellierung. Zur Analyse der Proteinkorona wird dynamische Lichstreuung, Massenspektrometrie, Mikrokalometrie, und eine kürzlich etablierten AF-FFF basierten Aufreinigungsmethode eingesetzt.
K. Landfester, M. Maskos, F. Schmid
Projektrelevante Publikationen seit 2017:
Alberg I, Kramer S, Schinnerer M, Qizhi H, Seidl C, Leps C, Drude N, Möckel D, Rijcken C, Lammers T, Diken M, Maskos M, Morsbach S, Landfester K, Tenzer S, Barz M, Zentel R. Polymeric nanoparticles with neglectable protein corona. (2020) Small. 18:1907574.
Prozeller D, Pereira J, Simon J, Mailänder V, Morsbach S, Landfester K. Prevention of Dominant IgG Adsorption on Nanocarriers in IgG-Enriched Blood Plasma by Clusterin Precoating. (2020) Adv. Sci. 6:1802199.
Steen EJL, Jorgensen JT, Johann K, Norregaard K, Sohr B, Svatunek D, Birke A, Shalgunov V, Edem PE, Rossin R, Seidl C, Schmid F, Robillard MS, Kristensen JL, Mikula H, Barz M, Kjaer A, Herth MM. Trans-Cyclooctene-Functionalized PeptoBrushes with Improved Reaction Kinetics of the Tetrazine Ligation for Pretargeted Nuclear Imaging. (2020) ACS Nano. 14:568-584.
Weber C, Morsbach S, Landfester K. Possibilities and Limitations of Different Separation Techniques for the Analysis of the Protein Corona. (2019) Angew. Chem. Int. Ed. 58:12787.
Mantha S, Qi SH, Barz M, Schmid F. How ill-defined constituents produce well-defined nanoparticles: Effect of polymer dispersity on the uniformity of copolymeric micelles. (2019) Phys. Rev. Mat. 3:026002.
Simon J, Müller J, Ghazaryan A, Morsbach S, Mailänder V, Landfester K. Protein denaturation caused by heat inactivation detrimentally affects biomolecular corona for-mation and cellular uptake. (2018) Nanoscale. 10:21096-21105.
Settanni G, Schäfer T, Muhl C, Barz M, Schmid F. Poly-sarcosine and Poly(Ethylene-Glycol) Interactions with Proteins Investigated Using Molecular Dynamics Simulations. (2018) Comp. Struct. Biot. J. 16:543-550.
Thiermann R, Bleul R, Maskos M. Kinetic control of block copolymer self-assembly in a micromixing device – mechanistical insight into vesicle formation process. (2017) Macromol. Chem. Phys. 218(2):1600347.
Settanni G, Zhou JJ, Suo TC, Schottler S, Landfester K, Schmid F, Mailänder V. Protein corona composition of poly(ethylene glycol)- and poly(phosphoester)-coated nanoparticles correlates strongly with the amino acid composition of the protein surface. (2017) Nanoscale. 9:2138-2144.
Heller P, Zhou JJ, Weber B, Hobernik D, Bros M, Schmid F, Barz M. The Influence of Block lonomer Microstructure on Polyplex Properties: Can Simulations Help to Understand Differences in Transfection Efficiency? (2017) Small. 13:1603694.
Observation of interaction forces by investigation of the influence of eluent additives on the retention behavior of aqueous nanoparticle dispersions in asymmetrical flow field-flow fractionation Conrad Nickel a , ∗, Christian Scherer a , Sergey Noskov a , Christoph Bantz b , Martin Berger a , Wolfgang Schupp c , Michael Maskos a , b; Journal of Chromatography A
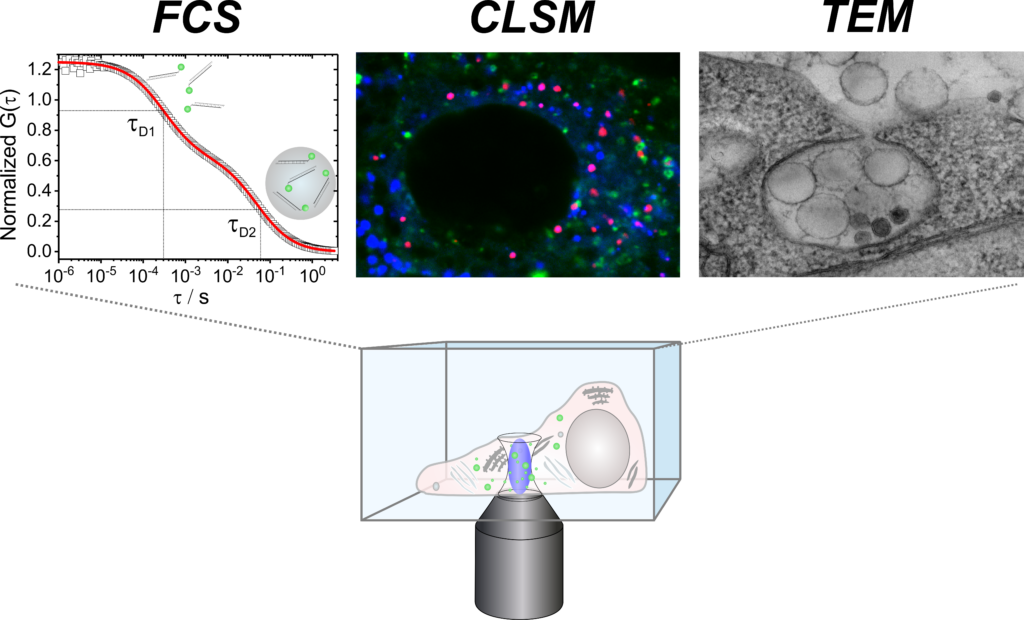
TP Q2 charakterisiert die Nanocarrier (NC) und ihre Wechselwirkungen mit biologischer Materie. Die ex-vivo-Fluorezenz-Korrelationsspektroskopie wird die NC-Kinetik im Blut lebender Tiere bezüglich Aggregation, Degradation oder vorzeitiger Wirkstoff-Freisetzung untersuchen. Die Struktur der NC-Proteinkorona und deren Einfluss auf die Endozytose wird mittels 3D Cryo-Elektronenmikroskopie untersucht. Weiterhin sollen Art und Effektivität der intrazellulären Wirkstofffreisetzung wie die Beladung des Major Histocompatibility Complexes (MHC) sowie die Stimulation von T-Zellen durch Proteomics der intrazellulären Kompartimente und durch Transkriptom-Analysen mittels RNASeq analysiert werden.
K. Koynov, I. Lieberwirth, V. Mailänder
Projektrelevante Publikationen seit 2017:
Jiang S, Prozeller D, Pereira J, Simon J, Han S, Wirsching S, Fichter M, Mottola M, Lieberwirth I, Morsbach S, Mailander V, Gehring S, Crespy D, Landfester K. Controlling protein interactions in blood for effective liver immunosuppressive therapy by silica nanocapsules. (2020) Nanoscale. 12:2626-2637.
Gai M, Simon J, Lieberwirth I, Mailander V, Morsbach S, Landfester K. A bio-orthogonal functionalization strategy for site-specific coupling of antibodies on vesicle surfaces after self-assembly. (2020) Polymer Chemistry. 11:527-540.
Holm R, Schwiertz D, Weber B, Schultze J, Kuhn J, Koynov K, Lächelt U, Barz M. Multifunctional Cationic PeptoStars as siRNA Carrier: Influence of Architecture and Histidine Modification on Knockdown Potential. (2020) Macromolecular Bioscience. 20:1900152.
Tabujew I, Willig M, Leber N, Freidel C, Negwer I, Koynov K, Helm M, Landfester K, Zentel R, Peneva K, Mailander V. Overcoming the barrier of CD8(+) T cells: Two types of nano-sized carriers for siRNA transport. (2019) Acta Biomaterialia. 100:338-351.
Kramer S, Svatunek D, Alberg I, Grafen B, Schmitt S, Braun L, van Onzen A, Rossin R, Koynov K, Mikula H, Zentel R. HPMA-Based Nanoparticles for Fast, Bioorthogonal iEDDA Ligation. (2019) Biomacromolecules. 20:3786-3797.
Guindani C, Frey ML, Simon J, Koynov K, Schultze J, Ferreira SRS, Araujo PHH, de Oliveira D, Wurm FR, Mailander V, Landfester K. Covalently Binding of Bovine Serum Albumin to Unsaturated Poly(Globalide-Co-epsilon-Caprolactone) Nanoparticles by Thiol-Ene Reactions. (2019) Macromolecular Bioscience. 19:1900145.
Reinholz J, Diesler C, Schöttler S, Kokkinopoulou M, Ritz S, Landfester K, Mailander V. Protein machineries defining pathways of nanocarrier exocytosis and transcytosis. (2018) Acta Biomaterialia. 71:432-443.
Negwer I, Best A, Schinnerer M, Schafer O, Capeloa L, Wagner M, Schmidt M, Mailander V, Helm M, Barz M, Butt HJ, Koynov K. Monitoring drug nanocarriers in human blood by near-infrared fluorescence correlation spectroscopy. (2018) Nature Communications. 9:5306.
Morsbach S, Gonella G, Mailander V, Wegner S, Wu S, Weidner T, Berger R, Koynov K, Vollmer D, Encinas N, Kuan S, Bereau T, Kremer K, Weil T, Bonn M, Butt HJ, Landfester K. Engineering Proteins at Interfaces: From Complementary Characterization to Material Surfaces with Designed Functions. (2018) Angewandte Chemie-International Edition. 57:12626-12648.
Nuhn L, Van Herck S, Best A, Deswarte K, Kokkinopoulou M, Lieberwirth I, Koynov K, Lambrecht BN, De Geest BG. FRET Monitoring of Intracellular Ketal Hydrolysis in Synthetic Nanoparticles. (2018) Angewandte Chemie-International Edition. 57:10760-10764.
oynov
Dieses Projekt zielt auf eine multiskalige Untersuchung der Körperverteilung der Trägersysteme (vom Organ zur Zelle) ab, wozu auch stärker optische Methoden (Fluoreszenz) integriert werden, mit dem Ziel sie im Vergleich mit PET zu validieren. Zudem soll ein zweiter Fokus auf dem Immuno-Imaging liegen, um das „Anspringen“ des Immunsystems nach Gabe immunstimulierender Nanoträger zu detektieren.
T. Lammers, M. Miederer, F. Rösch
Projektrelevante Publikationen seit 2017:
Sahin U, Oehm P, Derhovanessian E, Jabulowsky RA, Vormehr M, Gold M, Maurus D, Schwarck-Kokarakis D, Kuhn AN, Omokoko T, Kranz LM, Diken M, Kreiter S, Haas H, Attig S, Rae R, Cuk K, Kemmer-Bruck A, Breitkreuz A, Tolliver C, Caspar J, Quinkhardt J, Hebich L, Stein M, Hohberger A, Vogler I, Liebig I, Renken S, Sikorski J, Leierer M, Muller V, Mitzel-Rink H, Miederer M, Huber C, Grabbe S, Utikal J, Pinter A, Kaufmann R, Hassel JC, Loquai C, Tureci O. An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma. (2020) Nature. 585:107-112.
Pektor S, Schlöder J, Klasen B, Bausbacher N, Wagner DC, Schreckenberger M, Grabbe S, Jonuleit H, Miederer M. Using immuno-PET imaging to monitor kinetics of T cell-mediated inflammation and treatment efficiency in a humanized mouse model for GvHD. (2020) Eur J Nucl Med Mol I. 47:1314-1325.
Wagener K, Bros M, Krumb M, Langhanki J, Pektor S, Worm M, Schinnerer M, Montermann E, Miederer M, Frey H, Opatz T, Rosch F. Targeting of Immune Cells with Trimannosylated Lip-osomes. (2020) Adv Ther-Germany. 3:1900185.
May JN, Golombek SK, Baues M, Dasgupta A, Drude N, Rix A, Rommel D, von Stillfried S, Appold L, Pola R, Pechar M, van Bloois L, Storm G, Kuehne AJC, Gremse F, Theek B, Kiessling F, Lammers T. Multimodal and multiscale optical imaging of nanomedicine delivery across the blood-brain barrier upon sonopermeation. (2020) Theranostics. 10:1948-1959.
Alberg I, Kramer S, Schinnerer M, Hu QZ, Seidl C, Leps C, Drude N, Möckel D, Rijcken C, Lammers T, Diken M, Maskos M, Morsbach S, Landfester K, Tenzer S, Barz M, Zentel R. Polymeric Nanoparticles with Neglectable Protein Corona. (2020) Small. 16.
Stergiou N, Nagel J, Pektor S, Heimes AS, Jakel J, Brenner W, Schmidt M, Miederer M, Kunz H, Roesch F, Schmitt E. Evaluation of a novel monoclonal antibody against tumor-associated MUC1 for diagnosis and prognosis of breast cancer. (2019) Int J Med Sci. 16(9):1188-1198.
Theek B, Baues M, Gremse F, Pola R, Pechar M, Negwer I, Koynov K, Weber B, Barz M, Dechent W, Storm G, Kiessling F, Lammers T. Histidine-rich glycoprotein-induced vascular normalization improves EPR-mediated drug targeting to and into tumors. (2018) J Control Release. 282:25-34.
Eppard E, de la Fuente A, Mohr N, Allmeroth M, Zentel R, Miederer M, Pektor S, Rosch F. Labeling of DOTA-conjugated HPMA-based polymers with trivalent metallic radionuclides for molecular imaging. (2018) EJNMMI Research. 8:16.
Wagener K, Worm M, Pektor S, Schinnerer M, Thiermann R, Miederer M, Frey H, Rosch F. Comparison of Linear and Hyperbranched Polyether Lipids for Liposome Shielding by F-18-Radiolabeling and Positron Emission Tomography. (2018) Biomacromolecules. 19:2506-2516.
Pektor S, Hilscher L, Walzer KC, Miederer I, Bausbacher N, Loquai C, Schreckenberger M, Sahin U, Diken M, Miederer M. In vivo imaging of the immune response upon systemic RNA cancer vaccination by FDG-PET. (2018) Ejnmmi Res. 8.
In TP Q4 werden human-relevante Tiermodelle und in vitro-Ersatzsysteme für Tiermodelle für den SFB weiterentwickelt und charakterisiert, indem die genetische Variabilität und Neoantigen-Expression bei spontan entstehenden Melanomen in Mausmodellen untersucht und Methoden für eine standardisierbare Durchführung von Immuntherapie-Experimenten in spontanen Tumor-Modellen etabliert werden. Zudem sollen Tierversuchsersatzmodelle wie Tumor-Organoide weiterentwickelt werden, um Veränderungen im Tumormikromilieu zu analysieren und die Effekte der NP auf die tumorspezifische Immunantwort zu untersuchen.
M. Diken, H. Schild
Projektrelevante Publikationen seit 2017:
Sahin U, Oehm P, Derhovanessian E, Jabulowsky RA, Vormehr M, Gold M, Maurus D, Schwarck-Kokarakis D, Kuhn AN, Omokoko T, Kranz LM, Diken M, Kreiter S, Haas H, Attig S, Rae R, Cuk K, Kemmer-Brück A, Breitkreuz A, Tolliver C, Caspar J, Quinkhardt J, Hebich L, Stein M, Hohberger A, Vogler I, Liebig I, Renken S, Sikorski J, Leierer M, Müller V, Mitzel-Rink H, Miederer M, Huber C, Grabbe S, Utikal J, Pinter A, Kaufmann R, Hassel JC, Loquai C, Türeci Ö. An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma. (2020) Nature. 585(7823):107-112.
Scherger M, Bolli E, Antunes ARP, Arnouk S, Stickdorn J, Van Driessche A, Grabbe S, Schild H, De Geest BG, Van Ginderachter JA, Nuhn L. Transient Multivalent Nanobody Targeting to CD206-expressing Cells via pH-Degradable Nanogels. (2020) Cells. 9(10), 2222.
Alberg I, Kramer S, Schinnerer M, Hu Q, Seidl C, Leps C, Drude N, Möckel D, Rijcken C, Lammers T, Diken M, Maskos M, Morsbach S, Landfester K, Tenzer S, Barz M, Zentel R. Polymeric Nanoparticles with Neglectable Protein Corona. (2020) Small. 16(18):e1907574.
Reinhard K, Rengstl B, Oehm P, Michel K, Billmeier A, Hayduk N, Klein O, Kuna K, Ouchan Y, Wöll S, Christ E, Weber D, Suchan M, Bukur T, Birtel M, Jahndel V, Mroz K, Hobohm K, Kranz L, Diken M, Kühlcke K, Türeci Ö, Sahin U. An RNA vaccine drives expansion and efficacy of claudin-CAR-T cells against solid tumors. (2020) Science. 367(6476):446-453.
Grunwitz C, Salomon N, Vascotto F, Selmi A, Bukur T, Diken M, Kreiter S, Türeci Ö, Sahin U. HPV16 RNA-LPX vaccine mediates complete regression of aggressively growing HPV-positive mouse tumors and establishes protective T cell memory. (2019) Oncoimmunology. 8(9):e1629259.
Bialojan A, Sohl J, Rausch J, Aranda Lopez P, Denny M, Langguth P, Hartmann AK, Yagita H, Probst HC, Schild H, Radsak MP. Transcutaneous immunization with CD40 ligation boosts cytotoxic T lymphocyte mediated anti-tumor immunity independent of CD4 helper T cells in mice. (2019) Eur. J. Immunol. 49(11):2083-94.
Shen L, Tenzer S, Storck W, Hobernik D, Raker VK, Fischer K, Decker S, Dzionek A, Krauthäuser S, Diken M, Nikolaev A, Maxeiner J, Schuster P, Kappel C, Verschoor A, Schild H*, Grabbe S*, Bros M*. Protein corona-mediated targeting of nanocarriers to B cells allows redirection of allergic immune responses. (2018) J Allergy Clin Immunol. 142(5):1558-1570. *equally contributed to last authorship
Vormehr M, Reinhard K, Blatnik R, Josef K, Beck JD, Salomon N, Suchan M, Selmi A, Vascotto F, Zerweck J, Wenschuh H, Diken M, Kreiter S, Türeci Ö, Riemer AB, Sahin U. A non-functional neoepitope specific CD8+ T-cell response induced by tumor derived antigen exposure in vivo. (2018) Oncoimmunology. 8(3):1553478.
Shen L, Krauthäuser S, Fischer K, Hobernik D, Abassi Y, Dzionek A, Nikolaev A, Voltz N, Diken M, Krummen M, Montermann E, Tubbe I, Lorenz S, Strand D, Schild H, Grabbe S, Bros M. Vaccination with trifunctional nanoparticles that address CD8+ dendritic cells inhibits growth of established melanoma. (2016) Nanomedicine (Lond). 11(20):2647-2662.
Kranz LM*, Diken M*, Haas H, Kreiter S, Loquai C, Reuter KC, Meng M, Fritz D, Vascotto F, Hefesha H, Grunwitz C, Vormehr M, Hüsemann Y, Selmi A, Kuhn AN, Buck J, Derhovanessian E, Rae R, Attig S, Diekmann J, Jabulowsky RA, Heesch S, Hassel J, Langguth P, Grabbe S, Huber C, Türeci Ö, Sahin U. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. (2016) Nature. 534(7607):396-401. *equally contributed to first authorship.
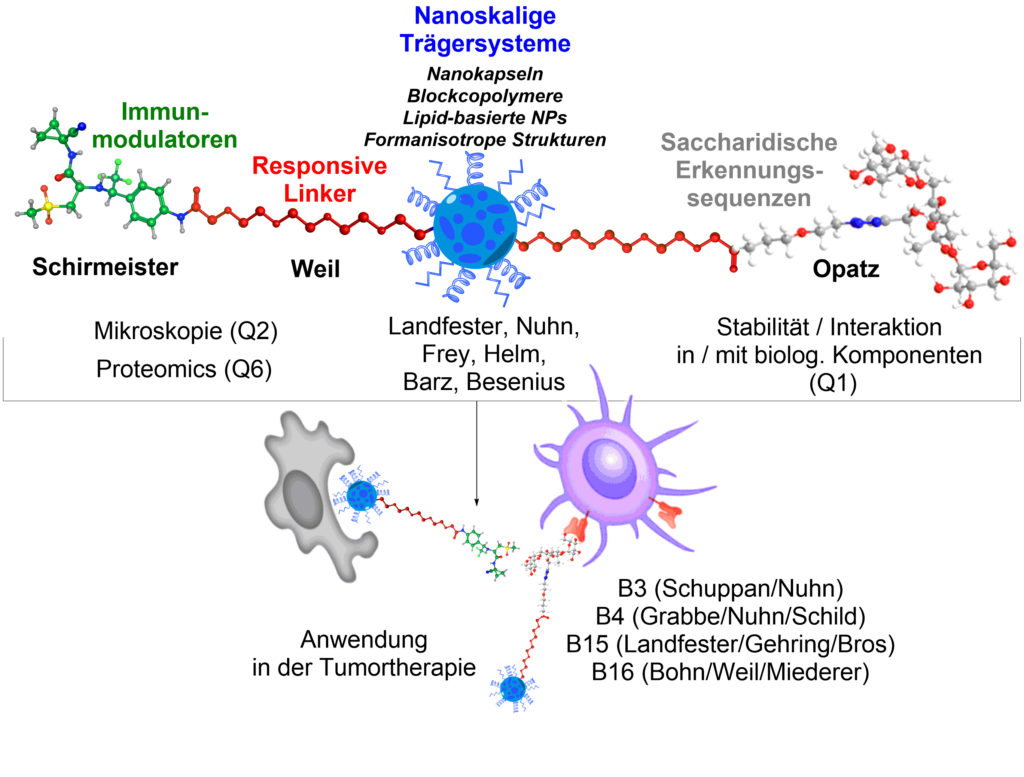
TP Q5 wird als neues Teilprojekt die im SFB vorhandenen Nanoträgersysteme im Hinblick auf chemische Methoden zur Ligation und selektive Targeting-Strukturen weiterentwickeln. Für ein effektives Targeting von Immunzellen sollen u.a. saccharidische Erkennungssequenzen (Oligosaccharide) über responsive Linkersysteme an die Nanoträger angebracht werden. Zur praktischen Anwendung von neu entwickelten Targetingstrukturen und deren Konjugationschemie sollen Hemmstoffe des Cystein-Cathepsin S, einem wichtigen Regulator der Antigenpräsentation, an Nanopartikel konjugiert oder nicht-kovalent darin verpackt werden und als Tumortherapeutikum evaluiert werden.
Opatz, T. Schirmeister, T. Weil
Projektrelevante Publikationen seit 2017:
Krumb M, Jäger M, Voss A, Immig L, Peters K, Kowalczyk D, Bufe A, Opatz T, Holst O, Vogel C, Peters M. Total Synthesis of a Partial Structure from Arabinogalactan and its Application for Allergy-Prevention. (2020) Chem. Eur.
Wagener K, Bros M, Krumb M, Langhanki J, Pektor S, Worm M, Schinnerer M, Montermann E, Miederer M, Frey H, Opatz T, Rösch F. Targeting of Immune Cells with Trimannosylated Liposomes. (2020) Adv. Therap. 1900185.
Klein P, Barthels F, Johe P, Wagner A, Tenzer S, Distler U, Le TA, Schmid P, Engel V, Engels B, Hellmich UA, Opatz* T, Schirmeister* T. Naphthoquinones as covalent reversible inhibitors of cysteine proteases – Studies on inhibition mechanisms and kinetics. (2020) Molecules. 25:2064.
Klein P, Johé P, Wagner A, Jung S, Engels B, Kühlborn J, Tenzer S, Distler U, Waigel W, Hellmich UA, Opatz* T, Schirmeister* T. New Cysteine Protease Inhibitors: Electrophilic (Het)arenes and unexpected Prodrug Identification. (2020) Molecules. 25:1451.
Fuchs N, Meta M, Schuppan* D, Nuhn* L, Schirmeister* T. Novel opportunities for cathepsin S inhibitors in cancer immunotherapy by nanocarrier-mediated delivery. (2020) Cells. 9:2021.
Xu L, Raabe M, Zegota MM, Nogueira JCF, Chudasama V, Kuan SL, Weil* T. Site-selective protein modification via disulfide rebridging for fast tetrazine/trans-cyclooctene bioconjugation. (2020) Org. Biomol. Chem. 18(6):1140-1147.
Hebel M, Riegger A, Zegota MM, Kizilsavas G, Gačanin J, Pieszka M, Lueckerath T, Coelho JAS, Wagner M, Gois PMP, Ng DYW, Weil* T. Sequence Programming with Dynamic Boronic Acid/Catechol Binary Codes. (2019) J. Am. Chem. Soc. 141(36):14026-14031.
Kramer S, Langhanki J, Krumb M, Opatz T, Bros M, Zentel R. HPMA-Based Nanocarriers for Effective Immune System Stimulation. (2019) Macromol. Biosci.1800481.
Agrawalla BK, Wang T, Riegger A, Domogalla MP, Steinbrink K, Dörfler T, Chen X, Boldt F, Lamla M, Michaelis J, Kuan SL, Weil T. Chemoselective Dual Labelling of Native and Recombinant Proteins. (2018) Bioconj. Chem. 29(1):29-34.
Schirmeister* T, Kesselring J, Jung S, Schneider T, Weickert A, Becker J, Lee W, Bamberger D, Wich P, Distler U, Tenzer S, Johé P, Hellmich UA, Engels* B. Quantum chemical-based protocol for the rational design of covalent inhibitors. (2016) J. Am. Chem. Soc. 138:8332-8335.
TP Q6 konzentriert sich auf die Analyse der Protein Corona und der Biodistribution der Nanocarrier nach systemischer Applikation. Aufbauend auf den erfolgreichen Vorarbeiten aus TP B11 und TP A7 soll die Zusammensetzung und Relevanz der Protein Corona für Blut-Zirkulationszeiten und das Targeting von NP weitergehend analysiert werden. TP Q6 wird hier insbesondere verschiedene Antikörperformate (ganzer Antikörper, Fab-Fragmente, scFv, Nanobodies) und ihre Eignung für das Targeting genauer charakterisieren. Außerdem werden die Auswirkungen unterschiedlicher Oberflächenmodifikationen (Variation von Polyether-Architekturen und Funktionalität) auf die Protein Corona untersucht.
V. Mailänder, S. Tenzer, F. Frey
Projektrelevante Publikationen seit 2017:
Wagner J, Li LJ, Simon J, Krutzke L, Landfester K, Mailänder V, Müllen K, Ng DYW, Wu YZ, Weil T. Amphiphilic Polyphenylene Dendron Conjugates for Surface Remodeling of Adenovirus 5. (2020) Angewandte Chemie Int. Ed. 59(14):5712-5720.
Keth J, Johann T, Frey H. Hydroxamic Acid – An Underrated Moiety? Marrying Bioinorganic Chemistry and Polymer Science. (2020) Biomacromolecules. 21(7):2546-2556.
Weber C, Voigt M, Simon J, Danner AK, Frey H, Mailänder V, Helm M, Morsbach S, Landfester K. Functionalization of Liposomes with Hydrophilic Polymers Results in Macrophage Uptake Independent of the Protein Corona. (2019) Biomacromolecules. 20(8):2989-2999.
Alberg I, Kramer S, Schinnerer M, Hu Q, Seidl C, Leps C, Drude N, Möckel D, Rijcken C, Lammers T, Diken M, Maskos M, Morsbach S, Landfester K, Tenzer S*, Barz M*, Zentel R*. Polymeric Nanoparticles with Neglectable Protein Corona. (2020) Small. 16(18):e1907574.
Distler U, Łącki MK, Schumann S, Wanninger M, Tenzer S. Enhancing Sensitivity of Microflow-Based Bottom-Up Proteomics through Postcolumn Solvent Addition. (2019) Anal Chem. 91(12):7510-7515.
Prozeller D, Pereira J, Simon J, Mailänder V, Morsbach S, Landfester K. Prevention of Dominant IgG Adsorption on Nanocarriers in IgG-Enriched Blood Plasma by Clusterin Precoating. (2019) Adv Sci. 6(10):1802199.
Shen L, Tenzer S, Storck W, Hobernik D, Raker VK, Fischer K, Decker S, Dzionek A, Krauthäuser S, Diken M, Nikolaev A, Maxeiner J, Schuster P, Kappel C, Verschoor A, Schild H, Grabbe S, Bros M. (2018) Protein corona-mediated targeting of nanocarriers to B cells allows redirection of allergic immune responses. (2018) J Allergy Clin Immunol. 142(5):1558-1570.
Tonigold M, Simon J, Estupinan D, Kokkinopoulou M, Reinholz J, Kintzel U, Kaltbeitzel A, Renz P, Domogalla MP, Steinbrink K, Lieberwirth I, Crespy D, Landfester K, Mailänder V. Pre-adsorption of antibodies enables targeting of nanocarriers despite a biomolecular corona. (2018) Nature Nanotechnology. 13(9):862-869.
Herzberger J, Niederer K, Pohlit H, Seiwert J, Worm M, Wurm FR, Frey H. Polymerization of Ethylene Oxide, Propylene Oxide and Other Alkylene Oxides: Synthesis, Novel Polymer Architectures and Bioconjugation. (2016) Chem. Rev. 116:2170-2243.
Fritz T, Voigt M, Worm M, Negwer I, Müller SS, Kettenbach K, Ross TL, Rösch F, Koynov K, Frey H, Helm M. Orthogonal click conjugation to the liposomal surface reveals stability of lipid anchorage as crucial for targeting. (2016) Chem. Eur J. 33:11578-11582.
Im Teilbereich B sind die Projekte zusammengefasst, die sich primär mit der Anwendung von Nanopartikeln und Polymeren für die Tumor-Immuntherapie beschäftigen.
M2-typische protumorale Makrophagen im Mikromilieu von Lebertumoren sollen mittels Blockcopolymer-basierter kationischer Nanogele in einen antitumoralen proinflammaltorischen M1-Phenotyp umgewandelt werden. Die Nanopartikel werden mit niedermolekularen Wirkstoffen, siRNA oder antisense-Oligonukleotiden beladen. Die gezielte Ansteuerung und damit effektivere Repolarisierung der M2-Makrophagen soll über Derivatisierung der Nanopartikel mit CD206-Rezeptor bindenden Peptiden oder Nanobodies weiter verbessert werden. Für die therapeutischen in vivo Effektivitätstestungen wurden 3 syngene Mausmodelle des hepatozellulären Karzinoms etabliert.
D. Schuppan, L. Nuhn
Projektrelevante Publikationen seit 2017:
Bixenmann L, Stickdorn J, Nuhn L*. Amphiphilic poly(esteracetal)s as dual pH- and enzyme-responsive micellar immunodrug delivery systems. (2020) Polym Chem. 11:2441-2456.
Fuchs N, Meta M, Schuppan D*, Nuhn L*, Schirmeister T*. Novel Opportunities for Cathepsin S Inhibitors in Cancer Immmunotherapy by Nanocarrier-mediated Delivery. (2020) Cells. 9(9):2021.
Kaps L, Leber N, Klefenz A, Choteschovsky N, Zentel R, Nuhn L*, Schuppan D*. In Vivo siRNA Delivery to Immunosuppressive Liver Macrophages by α-Mannosyl-Functionalized Cationic Nanohydrogel Particles. (2020) Cells. 9(8):1905.
Schupp J, Krebs FK, Zimmer N, Trzeciak E, Schuppan D*, Tuettenberg A*. Targeting myeloid cells in the tumor sustaining microenvironment. (2019) Cell Immunol. 343(9):103713.
Leber N, Kaps L, Yang A, Aslam M, Giardino M, Rosigkeit S, Mostafa A, Nuhn L*, Schuppan D*, Zentel R*. α-Mannosyl-Functionalized Cationic Nanohydrogel Particles for Targeted Gene Knockdown in Immunosuppressive Macrophages. (2019) Macromol Biosci. 19(7):1900162.
Foerster F, Hess M, Gerhold-Ay A, Marquardt JU, Becker D, Galle PR, Schuppan D, Binder H, Bockamp E. The immune contexture of hepatocellular carcinoma predicts clinical outcome. (2018) Sci Rep. 29(8):5351.
Weng SY, Wang X, Vijayan S, Tang Y, Kim YO, Padberg K, Regen T, Molokanova O, Chen T, Bopp T, Schild H, Brombacher F, Crosby JR, McCaleb ML, Waisman A, Bockamp E, Schuppan D. IL-4 Receptor Alpha Signaling through Macrophages Differentially Regulates Liver Fibrosis Progression and Reversal. (2018) EBioMedicine. 29:92-103.
Nuhn L*, Bolli E, Massa S, Vandenberghe I, Movahedi K, Devreese B, Van Ginderachter JA*, De Geest BG*. Targeting Protumoral Tumor-associated Macrophages with Nanobody-functionalized Nanogels through SPAAC Ligation. (2018) Bioconj Chem. 29(7)2394-2405.
Leber N, Kaps L, Aslam M, Schupp J, Brose A, Schäffel D, Fischer K, Diken M, Strand D, Koynov K, Tuettenberg A, Nuhn L*, Zentel R*, Schuppan D*. SiRNA-Mediated In Vivo Gene Knockdown by Acid-Degradable Cationic Nanohydrogel Particles. (2017) J Controlled Release. 248:10-23.
Leber N, Nuhn L, Zentel R. Cationic Nanohydrogel Particles For Therapeutic Oligonucleotide Delivery. (2017) Macromol Biosci. 17(10):1700092.
Multifunktionale Nanopartikel, die mit Tumorantigenen und immunstimulatorischen TLR-Agonisten ausgestattet sind, sowie über ein spezifisches Targeting antigenpräsentierende Zellen ansteuern, können nach systemischer Applikation eine effektive Immunantwort gegen etablierte murine Tumore auslösen. In diesem Teilprojekt werden dafür bioabbaubare, Poly(carbonat)-basierte Nanogele hergestellt und deren immuntherapeutische Effektivität in injizierten, metastatischen und induzierbaren Melanom-Modellen verglichen. Neben der Bedeutung verschiedener APC-Populationen und Immun-Effektorzellen soll die Rolle der B-Zelle für die Effektivität der Tumorvakzinierung untersucht werden.
S. Grabbe, L. Nuhn, H. Schild
Projektrelevante Publikationen seit 2017:
Sahin U, Oehm P, Derhovanessian E, Jabulowsky RA, Vormehr M, Gold M, Maurus D, Schwarck-Kokarakis D, Kuhn AN, Omokoko T, Kranz LM, Diken M, Kreiter S, Haas H, Attig S, Rae R, Cuk K, Kemmer-Brück A, Breitkreuz A, Tolliver C, Caspar J, Quinkhardt J, Hebich L, Stein M, Hohberger A, Vogler I, Liebig I, Renken S, Sikorski J, Leierer M, Müller V, Mitzel-Rink H, Miederer M, Huber C, Grabbe S, Utikal J, Pinter A, Kaufmann R, Hassel JC, Loquai C, Türeci Ö. An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma. (2020) Nature. 585(7823):107-112.
Schaupp L, Muth S, Rogell L, Kofoed-Branzk M, Melchior F, Lienenklaus S, Ganal-Vonarburg SC, Klein M, Guendel F, Hain T, Schütze K, Grundmann U, Schmitt V, Dorsch M, Spanier J, Larsen PK, Schwanz T, Jäckel S, Reinhardt C, Bopp T, Danckwardt S, Mahnke K, Heinz GA, Mashreghi MF, Durek P, Kalinke U, Kretz O, Huber TB, Weiss S, Wilhelm C, Macpherson AJ, Schild H*, Diefenbach A*, Probst HC*. Microbiota-induced tonic type I interferons instruct a transcriptional, epigenetic and metabolic program that defines the basal state of conventional dendritic cells. (2020) Cell. 181:1-17.
Kockelmann J, Stickdorn J, Kasmi S, De Vrieze J, Pieszka M, Ng, DYW, David SA, De Geest BG, Nuhn L. Control over immune stimulation by pH-degradable poly(norbornene) nanogels. (2020) Biomacromolecules. 21(6):2246-2257.
Scherger M, Bolli E, Antunes ARP, Arnouk S, Stickdorn J, Van Driessche A, Grabbe S, Schild H, De Geest BG, Van Ginderachter JA*, Nuhn L*. Transient multivalent nanobody targeting to CD206-expressing cells via pH-degradable nanogels. (2020) Cells. 9:2222.
Lybaert L, Vermaelen K, De Geest BG, Nuhn L. Immunoengineering through cancer vaccines – a personalized and multi-step vaccine approach towards precise cancer immunity. (2018) J Control Release. 289:125-145.
Paßlick D, Piradashvili K, Bamberger D, Li M, Jiang S, Strand D, R Wich P, Landfester K, Bros M, Grabbe S*, Mailänder V*. Delivering all in one: Antigen-nanocapsule loaded with dual adjuvant yields superadditive effects by DC-directed T cell stimulation. (2018) J Control Release. 289:23-34.
Bros M, Nuhn L, Simon J, Moll L, Mailänder V, Landfester K, Grabbe S. The protein corona as a con-founding variable of nanoparticle-mediated targeted vaccine delivery. (2018) Front Immunol. 9:1760.
Shen L, Tenzer S, Storck W, Hobernik D, Raker VK, Fischer K, Decker S, Dzionek A, Krauthäuser S, Diken M, Nikolaev A, Maxeiner J, Schuster P, Kappel C, Verschoor A, Schild H*, Grabbe S*, Bros M*. Protein corona-mediated targeting of nanocarriers to B cells allows redirection of allergic immune responses. (2018) J Allergy Clin Immunol. 142(5):1558-1570.
Nuhn L, De Koker S, Van Lint S, Zhong Z, Catani JP, Combes F, Deswarte K, Li Y, Lambrecht BN, Lienenklaus S, Sanders NN, David SA*, Taverrnier J*, De Geest BG*. Nanoparticle-conjugated TLR7/8 agonist localized immunotherapy provokes safe and synergistic antitumoral responses. (2018) Adv Mater. 30(45):1803397.
Weber B, Kappel C, Scherer M, Helm M, Bros M, Grabbe S, Barz M. PeptoSomes for vaccination: combining antigen and adjuvant in polypept(o)id-based polymersomes. (2017) Macromol Biosci. 17(10).
Das Teilprojekt zielt auf die Entwicklung von DNA-Vakzinen ab, die unter der transkriptionellen Kontrolle des Fascin-Promotors stehen und daher bevorzugt in DCs aktiviert werden. Um effektive Transfektionsagenzien für diese, schwer zu transfizierenden Zellen, zu erhalten wird die Expertise von E. Wagner und R. Zentel kombiniert werden, um funktionelle, stimulus-responsive Trägersysteme zu entwickeln.
M. Bros, E. Wagner, R. Zentel
Projektrelevante Publikationen seit 2017:
Hager S, Fittler FJ, Wagner E, Bros M. Nucleic acid-based approaches for tumor therapy. (2020) MDPI Cells.
Ritt N, Berger S, Wagner E, Zentel R. Versatile, Multifunctional Block-Copolymers for the Self-Assembly of Well-Defined, Non-Toxic pDNA Polyplexes. (2020) ACS Applied Polymer Materials.
Wagener K, Bros M, Krumb, M, Langhanki J, Pektor S, Worm M, Schinnerer M, Montermann E, Miederer M, Frey H, Opatz T, Rösch F. Targeting of Immune Cells with Trimannosylated Liposomes. (2020) Advanced Therapeutics. 3:1900185.
Kramer S, Langhanki J, Krumb M, Opatz T, Bros M, Zentel R. HPMA-Based Nanocarriers for Effective Immune System Stimulation. (2019) Macromol Biosci. 19(6):e1800481.
Klein PM, Kern S, Lee DJ, Schmaus J, Höhn M, Gorges J, Kazmaier U, Wagner E. Folate receptor-directed orthogonal click-functionalization of siRNA lipopolyplexes for tumor cell killing in vivo. (2018) Biomaterials.
Reinhard S, Wang Y, Dengler S, Wagner E. Precise Enzymatic Cleavage Sites for Improved Bioactivity of siRNA Lipo-Polyplexes. (2018) Bioconjug Chem. 29:3649-3657.
Shen L, Tenzer S, Storck W, Hobernik D, Raker VK, Fischer K, Decker S, Dzionek A, Krauthäuser S, Diken M, Nikolaev A, Maxeiner J, Schuster P, Kappel C, Verschoor A, Schild H, Grabbe S, Bros M. Protein corona-mediated targeting of nanocarriers to B cells allows redirection of allergic immune responses. (2018) J Allergy Clin Immunol. 142(5):1558-1570.
Moog KE, Barz M, Bartneck M, Beceren-Braun F, Mohr N, Wu Z, Braun L, Dernedde J, Liehn EA, Tacke F, Lammers T, Kunz H, Zentel R. Polymeric Selectin Ligands Mimicking Complex Carbohydrates: From Selectin Binders to Modifiers of Macrophage Migration. (2017) Angew. Chem. Int. Ed. 56(5):1416-421.
Krhac Levacic A, Morys S, Kempter S, Lächelt U, Wagner E. Minicircle Versus Plasmid DNA Delivery by Receptor-Targeted Polyplexes. (2017) Human Gene Ther. 28(10).
Heller P, Hobernik D, Lächelt U, Schinnerer M, Weber B, Schmidt M, Wagner E, Bros M, Barz M. Combining reactive triblock copolymers with functional cross-linkers: A versatile pathway to disulfide stabilized-polyplex libraries and their application as pDNA vaccines. (2017) J Control Release. 258:146-160.
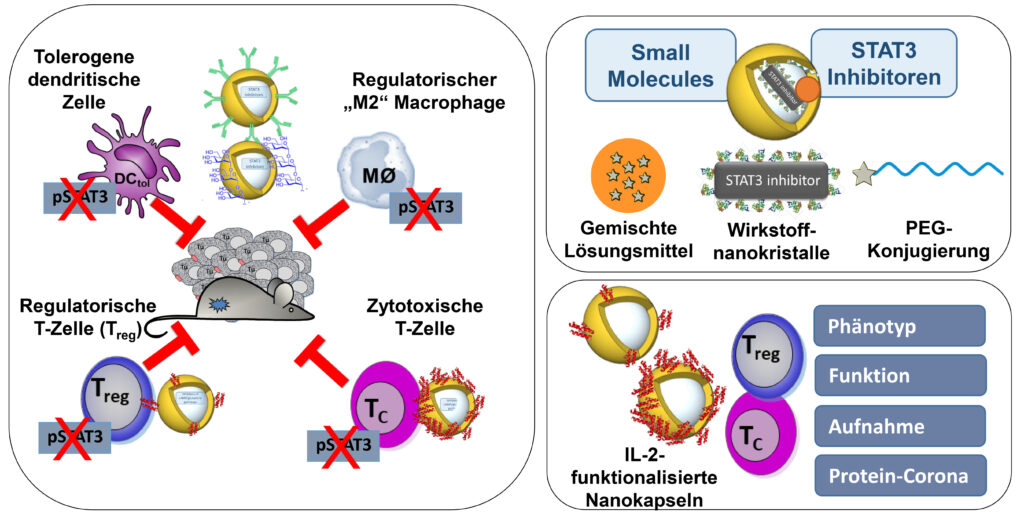
Durch den Einsatz von Nanokapseln sollen STAT3-abhängige Tumor-assoziierte Toleranzprozesse in Immunzellen beeinflusst werden. Mit Hilfe der etablierten Methoden zur Verpackung von Small Molecules (STAT3-Inhibitoren) und zur Herstellung IL-2-funktionalisierter Nanokapseln zum Targeting von T-Zellen werden Aufnahmemechanismen und Wirkung (Funktion, Transkriptom/Proteom) auf regulatorische FOXP3+ und zytotoxische CD8+ T-Zellen und in tolerogenen DC/myeloiden Zellen analysiert werden. Außerdem wird die therapeutische Wirkung in Melanommodellen (murin, humanisiert [MISTRG]) in vivo getestet und mit weiteren Immuntherapien kombiniert.
K. Landfester, K. Steinbrink
Projektrelevante Publikationen seit 2017:
Frey ML, Simon J, Brückner M, Mailänder V, Morsbach S, Landfester K. Bio-orthogonal triazolinedione (TAD) crosslinked protein nanocapsules affect protein adsorption and cell interaction. Polym Chem. 2020, 11, 3821–383.
Raker V, Becker C, Landfester K, Steinbrink K. Targeted activation of T cells with IL-2-coupled nanoparticles. Cells. 2020, 9, 9, E2063.
Gai M, Simon J, Lieberwirth I, Mailänder V, Morsbach S, Landfester K. A bio-orthogonal functionalization strategy for site-specific coupling of antibodies on vesicle surfaces after self-assembly. Polym. Chem. 2020, 11, 527-540.
Stegemann A, Flis D, Ziolkowski W, Distler JHW, Steinbrink K, Böhm M, Stegemann A. The α7 nicotinic acetylcholine receptor: a promising target for the treatment of fibrotic skin disorders. J Invest Dermatol. 2020; 23:S0022-202X(20)31399-3.
Thiramanas R, Jiang S, Simon J, Landfester K, Mailänder V. Silica Nanocapsules with Different Sizes and Physicochemical Properties as Suitable Nanocarriers for Uptake in T-Cells. Intern. J. Nanomedicine 2020, 15, 6069–6084
Haub J, Roehrig N, Uhrin P, Schabbauer G, Eulberg D, Melchior F, Shahneh F, Probst HC, Becker C, Steinbrink K*, Raker VK* Intervention of inflammatory monocyte activity limits dermal fibrosis. J Invest Dermatol. 2019, 139, 2144-2153. *equal contribution
Guindani C, Frey ML, Simon J, Koynov K, Schultze J, Ferreira SRS, Araujo PHH, Oliveira D, Wurm FR, Mailänder V, Landfester K. Covalently Binding of Bovine Serum Albumin to UnsaturatedPoly(Globalide-Co-epsilon-Caprolactone) Nanoparticles by Thiol-Ene Reactions, Macromol Biosci, 2019, 19(10), e1900145.
Kleszczyński K, Kim TK, Bilska B, Sarna M, Mokrzynski K, Stegemann A, Pyza E, Reiter RJ, Steinbrink K, Böhm M, Slominski AT, Kleszczyński K. Melatonin exerts oncostatic capacity and decreases melanogenesis in human MNT-1 melanoma cells. J Pineal Res. 2019; 67(4):e12610.
Agrawalla BK, Wang T, Riegger A, Domogalla MP, Steinbrink K, Dörfler T, Chen X, Boldt F, Lamla M, Michaelis J, Kuan SL, Weil T. Chemoselective dual labeling of native and recombinant proteins. Bioconjug Chem. 2018; 29: 29-34.
Schmidt T, Lorenz N, Raker VK, Schmidgen MI, Mahnke K, Enk A, Roth J, Steinbrink K. Allergen-specific low zone tolerance is independent of MRP8/14-, TLR4-, TLR7-, and TLR9-mediated immune processes. J Invest Dermatol. 2018; 138: 452-455.
Tonigold M, Simon J, Estupinan D, Kokkinopoulou M, Reinholz J, Kintzel U, Kaltbeitzel A, Renz P, Domogalla MP, Steinbrink K, Lieberwirth I, Crespy D, Landfester K, Mailänder V. Pre-adsorption of antibodies enables targeting of nanocarriers despite a biomolecular corona. Nat Nanotechnol. 2018, 13, 862-869.
Passlick D, Piradashvili K, Bamberger D, Li M, Jiang S, Strand D, Wich P, Landfester K, Bros M, Grabbe S, Mailänder V. Delivering all in one: Antigen-nanocapsule loaded with dual adjuvant yields superadditive effects by DC-directed T cell stimulation, J. Contr. Release 2018, 289, 23-34
Alkanawati MS, Wurm FR, Therien-Aubin H, Landfester K. Large-Scale Preparation of Polymer Nanocarriers by High-Pressure Microfluidization. Macromol Mater Eng. 2018, 303, Art. No. 1700505
Haeberle S, Raker V, Haub J, Kim YO, Weng SY, Yilmaz OK, Enk A, Steinbrink K*, Schuppan D*, Hadaschik EN.* Regulatory T cell deficient scurfy mice exhibit a Th2/M2-like inflammatory response in the skin. J Dermatol Sci. 2017, 87, 285-291. *equal contribution
Piradashvili K, Simon J, Passlick D, Hoehner JR, Mailänder V, Wurm FR, Landfester K. Fully degradable protein nanocarriers by orthogonal photoclick tetrazole-ene chemistry for the encapsulation and release. Nanoscale Horizons. 2017, 2, 297-302.
Domogalla MP, Rostan PV, Raker VK, Steinbrink K. Tolerance through education: how tolerogenic dendritic cells shape immunity. Front Immunol. 2017; 11;8:1764. doi: 10.3389/fimmu.2017.01764.
Raker V, Haub J, Stojanovic A, Cerwenka A, Schuppan D, Steinbrink K. Early inflammatory players in cutanous fibrosis. J Dermatol Sci. 2017; 87:228-235.
Müller, J.; Bauer, KN.; Prozeller, D.; Simon, J.; Mailander, V.; Wurm, F.R.; Winzen, S.; Landfester, K. Coating nanoparticles with tunable surfactants facilitates control over the protein corona. Biomaterials. 2017, 115, 1-8.
Wir haben gezeigt, dass Adenylylzyklase Inhibitor-beladene Polypept(o)id-Mizellen durch Repression der intratumoralen cAMP-Bildung das Wachstum von Melanomen unterdrücken. In Vorbereitung einer klinischen Studie soll nun die Wirkung der partikelvermittelten cAMP-Repression auf menschliche Melanome und syngene menschliche Immunzellen im humanisierten MISTRG-Mausmelanom-Modell untersucht werden. Unser Ziel ist es, die Mizellen-vermittelte cAMP-Repression durch adjuvante Nanopartikel noch effektiver zu machen und die beteiligten Signaltransduktionswege in tumorinfiltrierenden Leukozyten durch vergleichende Transkriptomanalysen zu identifizieren.
M. Barz, C. Becker, T. Bopp
Projektrelevante Publikationen seit 2017:
Dal NK, Kocere A, Wohlmann J, Van Herck S, Bauer TA, Resseguier J, Bagherifam S, Hyldmo H, De Geest BG, Barz M, Fenaroli F. Zebrafish Embryos Allow Prediction of Nanoparticle Circulation Times in Mice and Facilitate Quantification of Nanoparticle-Cell Interactions. (2020) Small. 1906719.
Bohn T, Rapp S, Luther N, Klein M, Bruehl TJ, Kojima N, Aranda Lopez P, Hahlbrock J, Muth S, Endo S, Pektor S, Brand A, Renner K, Popp V, Gerlach K, Vogel D, Lueckel C, Arnold-Schild D, Pouyssegur J, Kreutz M, Huber M, Koenig J, Weigmann B, Probst HC, von Stebut E, Becker C, Schild H, Schmitt E, and Bopp T. Tumor immunoevasion via acidosis dependent induction of regulatory tumor-associated macrophages. (2018) Nature Immunology. 19(12):1319-1329.
Fenaroli F, Repnik U, Xu Y, Johann K, Van Herck S, Dey P, Skjeldal FM, Frei DM, Bagherifam S, Kocere A, Haag R, De Geest BG, Barz M, Griffiths G. Enhanced permeability and retention-like extravasation of nanoparticles from the vasculature into tuberculosis granulomas in zebrafish and mouse models. (2018) ACS nano. 12(8):8646-8661.
Muhl C, Schäfer O, Bauer T, Räder HJ, Barz M. Poly(S-ethylsulfonyl-l-homocysteine): An α-Helical Polypeptide for Chemoselective Disulfide Formation. (2018) Macromolecules. 51(20):8188-8196.
Schäfer O, Klinker K, Braun L, Huesmann D, Schultze J, Koynov K, Barz M. Combining orthogonal reactive groups in block copolymers for functional nanoparticle synthesis in a single step. (2017) ACS Macro Letters. 6(10):1140-1145.
Klinker K, Schäfer O, Huesmann D, Bauer T, Capelôa L, Braun L, Stergiou N, Schinnerer M, Dirisala A, Miyata K, Osada K, Cabral H, Kataoka K, Barz M. Secondary-Structure-Driven Self-Assembly of Reactive Polypept(o)ides: Controlling Size, Shape, and Function of Core-Crosslinked Nanostructures. (2017) Angew. Chem. Intern. Ed. 56(32):9608-9613.
Birke A, Huesmann D, Kelsch A, Weilbächer M, Xie J, Bros M, Bopp T, Becker C, Landfester K, Barz M. Polypeptoid-block-polypeptide copolymers: synthesis, characterization, and application of amphiphilic block Copolypept(o)ides in drug formulations and miniemulsion techniques. (2014) Biomacromolecules. 15(2):548-57.
Bacher N, Raker V, Hofmann C, Graulich E, Schwenk M, Baumgrass R, Bopp T, Zechner U, Merten L, Becker C, Steinbrink K. Interferon-α suppresses cAMP to disarm human regulatory T cells. (2013) Cancer Res. 73(18):5647-56.
Becker C, Bopp T, Steinbrink K. Interferon α interferes with immunological tolerance. (2013) Oncoimmunology. 2(12):e27528.
Vaeth M*, Gogishvili T*, Bopp T*, Klein M, Berberich-Siebelt F, Gattenloehner S, Avots A, Sparwasser T, Grebe N, Schmitt E, Hünig T, Serfling E, Bodor J. Regulatory T cells facilitate the nuclear accumulation of inducible cAMP early repressor (ICER) and suppress nu-clear factor of activated T cell c1 (NFATc1). (2011) Proc Natl Acad Sci U S A. 108(6):2480-5. *Joint first authors
Ausgehend von der für einige Nanopartikelsysteme beobachteten Bedeutung der Protein Korona für zelluläre Aufnahme und das intrazelluläre Trafficking beschäftigt sich dieses Projekt mit drei Themenfeldern: (1) der weitergehenden Analyse der Koronabildung an andere Trägersysteme sowie deren Auswirkung, (2) des Studiums der Möglichkeit durch Vorbildung einer Korona die Biodistribution zu verändern und (3) der chemischen Anbindung von wichtigen Proteinen wie Clusterin, um so ein „stealth-artiges“ Verhalten zu erreichen.
V. Mailänder, S. Tenzer, T. Weil
Projektrelevante Publikationen seit 2017:
Alberg I, Kramer S, Schinnerer M, Hu Q, Seidl C, Leps C, Drude N, Möckel D, Rijcken C, Lammers T, Diken M, Maskos M, Morsbach S, Landfester K, Tenzer S*, Barz M*, Zentel R*. Polymeric Nanoparticles with Neglectable Protein Corona. (2020) Small. 16(18):e1907574.* Corresponding authors
Xu L, Raabe M, Zegota MM, Nogueira J, Chudasama V, Kuan SL, Weil T. Site-selective protein modification via disulfide rebridging for fast tetrazine/trans-cyclooctene bioconjugation. (2020) Org. Biomol. Chem.
Wagner J, Li L, Simon J, Krutzke L, Müllen K, Landfester K, Mailänder V, Ng DYW, Wu YZ, Weil T. Amphiphilic Polyphenylene Dendron Conjugates for Surface Remodeling of Adenovirus 5. (2020) Angewandte Chemie International Edition. 59(14):5712-5720. Angewandte Chemie. 132(14):5761-5769.
Wagner J, Dillenburger M, Simon J, Oberländer J, Landfester K, Mailänder V, Ng DYW, Müllen K, Weil T. Amphiphilic Dendrimers Control Protein Binding and Corona Formation on Liposome Nanocarriers. (2020) Chemical Communications. 56(61):8663-8666.
Weber C, Voigt M, Simon J, Danner AK, Frey H, Mailänder V, Helm M, Morsbach S, Landfester K. Functionalization of Liposomes with Hydrophilic Polymers Results in Macrophage Uptake Independent of the Protein Corona. (2019) Biomacromolecules. 20(8):2989-2999.
Distler U, Łącki MK, Schumann S, Wanninger M, Tenzer S. Enhancing Sensitivity of Microflow-Based Bottom-Up Proteomics through Postcolumn Solvent Addition. (2019) Anal Chem.. 91(12):7510-7515.
Prozeller D, Pereira J, Simon J, Mailänder V, Morsbach S, Landfester K. Prevention of Dominant IgG Adsorption on Nanocarriers in IgG-Enriched Blood Plasma by Clusterin Precoating. (2019) Adv Sci. 6(10):1802199.
Tonigold M, Simon J, Estupinan D, Kokkinopoulou M, Reinholz J, Kintzel U, Kaltbeitzel A, Renz P, Domogalla MP, Steinbrink K, Lieberwirth I, Crespy D, Landfester K, Mailänder V. Pre-adsorption of antibodies enables targeting of nanocarriers despite a biomolecular corona. (2018) Nature Nanotechnology. 13(9):862-869.
Shen L, Tenzer S, Storck W, Hobernik D, Raker VK, Fischer K, Decker S, Dzionek A, Krauthäuser S, Diken M, Nikolaev A, Maxeiner J, Schuster P, Kappel C, Verschoor A, Schild H, Grabbe S, Bros M. Protein corona-mediated targeting of nanocarriers to B cells allows redirection of allergic immune responses. (2018) J Allergy Clin Immunol. 142(5):1558-1570.
Zegota MM, Wang T, Seidler C, Ng DYW, Kuan SL, Weil T. “Tag and Modify” Protein Conjugation with Dynamic Covalent Chemistry. (2018) Bioconjugate Chemistry. 29(8):2665-2670.
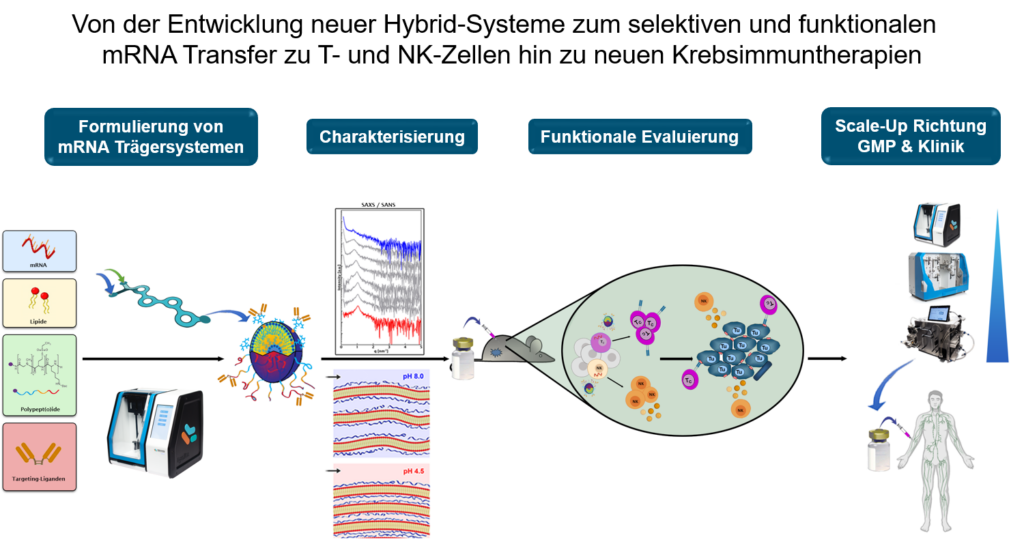 Ziel des TP B12 ist die Entwicklung medizinisch anwendbarer nanopartikulärer Trägersysteme um eine funktionelle Modulation von T- und NK-Zellen durch mRNA-kodierte Zytokine zu erreichen. Die hierzu erforderlichen RNA-Lipoplex-NP befinden sich bereits in der klinischen Erprobung zur Immuntherapie des Melanoms. Zur Weiterentwicklung dieses Konzepts auf T- und NK-Zellen wurden Polymer-Lipid-Hybrid-Trägersysteme aus Lipiden und Polymeren wie auch Ligandensysteme etabliert, die in Bezug auf eine klinische Translation für Immuntherapien des Melanoms eingesetzt werden sollen.
Ziel des TP B12 ist die Entwicklung medizinisch anwendbarer nanopartikulärer Trägersysteme um eine funktionelle Modulation von T- und NK-Zellen durch mRNA-kodierte Zytokine zu erreichen. Die hierzu erforderlichen RNA-Lipoplex-NP befinden sich bereits in der klinischen Erprobung zur Immuntherapie des Melanoms. Zur Weiterentwicklung dieses Konzepts auf T- und NK-Zellen wurden Polymer-Lipid-Hybrid-Trägersysteme aus Lipiden und Polymeren wie auch Ligandensysteme etabliert, die in Bezug auf eine klinische Translation für Immuntherapien des Melanoms eingesetzt werden sollen.
M. Barz, P. Langguth, U. Sahin
Projektrelevante Publikationen seit 2017:
Sahin U, Oehm P, Derhovanessian E, Jabulowsky RA, Vormehr M, Gold M, Maurus D, Schwarck-Kokarakis D, Kuhn AN, Omokoko T, Kranz LM, Diken M, Kreiter S, Haas H, Attig S, Rae R, Cuk K, Kemmer-Brück A, Breitkreuz A, Tolliver C, Caspar J, Quinkhardt J, Hebich L, Stein M, Hohberger A, Vogler I, Liebig I, Leierer M, Müller V, Mitzel-Rink H, Miederer M, Huber C, Grabbe S, Utikal J, Pinter A, Kaufmann R, Hassel JC, Loquai C, Türeci Ö. An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma. (2020) Nature. 585(7823):107-112.
Nogueira S, Schlegel A, Maxeiner K, Weber B, Barz M, Schroer M A, Blanchet C E, Svergun D, Ramishetti S, Peer D, Langguth P, Sahin U, Haas H. Polysarcosine-Functionalized Lipid Nanoparticles for Therapeutic mRNA Delivery. (2020) ACS Applied Nano Materials. DOI: 10.1021/acsanm.Oc01834.
Siewert C, Haas H, Cornet V, Nogueira SS, Nawroth T, Uebbing L, Ziller A, Al-Gousous J, Radulescu A, Schroer MA, Blanchet CE, Svergun DI, Radsak MP, Sahin U, Langguth P. Hybrid Biopolymer and Lipid Nanoparticles with Improved Transfection Efficacy for mRNA. (2020) Cells. 9(9): 2034.
Uebbing L, Ziller A, Siewert C, Schroer MA, Clement BE, Svergun DI, Ramishetti S, Peer D, Sahin U, Haas H, Langguth P. Investigation of pH-responsiveness inside lipid nanoparticles for parenteral mRNA application using small angle X-ray scattering. (2020) Langmuir. DOI: 10.1021/acs.langmuir.0c02446.
Siewert C, Haas H, Nawroth T, Ziller A, Nogueira SS, Schroer MA, Blanchet CE, Svergun DI, Radulescu A, Bates F, Huesemann Y, Radsak MP, Sahin U, Langguth P. Investigation of charge ratio variation in mRNA – DEAE-dextran polyplex delivery systems. (2019) Biomaterials. 192:612-620
Sun Q, Barz M, De Geest BG, Diken M, Hennink WE, Lammers T, Shi Y. Nanomedicine and macroscale materials in immuno-oncology. (2019) Chem. Soc. Rev. 48(1):351-381.
Bleher S, Buck J, Muhl C, Sieber S, Barnert S, Witzigmann D, Huwyler J, Barz M, Süss R. Poly(Sarcosine) Surface Modification Imparts Stealth-Like Properties to Liposomes. (2019) Small. 15(50):e1904716.
Ziller A, Nogueira SS, Hühn E, Funari SS, Brezesinski G, Hartmann H, Sahin U, Haas H, Langguth P. Incorporation of mRNA in Lamellar Lipid Matrices for Parenteral Administration. (2018) Molecular pharmaceutics. 15(2):642-651.
Heller P, Zhou J, Weber B, Hobernik D, Bros M, Schmid F, Barz M. The Influence of Block Ionomer Microstructure on Polyplex Properties: Can Simulations Help to Understand Differences in Transfection Efficiency? (2017) Small. 13(17).
Heller P, Hobernik D, Lächelt U, Schinnerer M, Weber B, Schmidt M, Wagner E, Bros M, Barz M. Combining reactive triblock copolymers with functional cross-linkers: A versatile pathway to disulfide stabilized-polyplex libraries and their application as pDNA vaccines. (2017) Journal of controlled release. 258:146-160.
TP B13 hat eine modulare Vakzinplattform entwickelt, die aus frei miteinander kombinierbaren selbst-organisierenden Bausteinen besteht, die zu formanisotropen multiunktionellen Nanostäbchen assemblieren. In der letzten Antragsperiode wurde sie erfolgreich zum Aufbau von synthetischen Vakzinen gegen tumor-assoziiertes Mucin 1 angewendet und soll nun im Kontext des malignen Melanoms erprobt werden. Vom Melanom-assoziierten Oberflächen-protein CSPG4 abgeleitete B-Zell-Epitope werden hierzu auf der Stäbchenoberfläche präsentiert und in murinen Melanommodellen auf eine Induktion von Tumor-spezifischen Antikörpern und T-Zellen und ihre therapeutische Wirkung getestet.
P. Besenius, T. Bopp
Projektrelevante Publikationen seit 2017:
Stergiou N, Nagel J, Pektor S, Heimes AS, Jäkel J, Brenner W, Schmidt M, Miederer M, Kunz H, Rösch F, Schmitt E. Evaluation of a novel monoclonal antibody against tumor-associated MUC1 for diagnosis and prognosis of breast cancer. (2019) Int J Med Sci. 16:1188-1198.
Stergiou N, Gaidzik N, Heimes AS, Dietzen S, Besenius P, Jäkel J, Brenner W, Schmidt M, Kunz H, Schmitt E. Reduced Breast Tumor Growth After Immunization with a Tumor-Restricted MUC1 Glycopeptide Conjugated to Tetanus Toxoid. (2019) Cancer Immunol Res. 7:113-122.
Straßburger D, Glaffig M, Stergiou N, Bialas S, Besenius P, Schmitt E, Kunz H. Synthetic MUC1 Antitumor Vaccine with Incorporated 2,3-Sialyl-T Carbohydrate Antigen Inducing Strong Immune Responses with Isotype Specificity. (2018) ChemBioChem. 19:1142-1146.
Straßburger D, Stergiou N, Urschbach M, Yurugi H, Spitzer D, Schollmeyer D, Schmitt E, Besenius P. Mannose-Decorated Multicomponent Supramolecular Polymers Trigger Effective Uptake into Antigen-Presenting Cells. (2018) ChemBioChem. 19:912-916.
Glaffig M, Stergiou N, Hartmann S, Schmitt E, Kunz H. A Synthetic MUC1 Anticancer Vaccine Containing Mannose Ligands for Targeting Macrophages and Dendritic Cells. (2018) ChemMedChem. 13:25-29.
Stergiou N, Glaffig M, Jonuleit H, Kunz H, Schmitt E. Immunization With a Synthetic Human MUC1 Glycopeptide Vaccine Against Tumor-Associated MUC1 Breaks Tolerance in Human MUC1 Transgenic Mice. (2017) ChemMedChem. 12:1424-1428.
Spitzer D, Rodrigues LL, Straßburger D, Mezger M, Besenius P. Tuneable Transient Thermogels Mediated by a pH- and Redoxregulated Supramolecular Polymerization. (2017) Angew. Chem. Int. Ed. 56:15461-15465.
Jonuleit H, Bopp T, Becker C. Treg cells as potential cellular targets for functionalized nanoparticles in cancer therapy. (2016) Nanomedicine. 11:2699-2709.
Frisch H, Nie Y, Raunser S, Besenius P. pH-Regulated Selectivity in Supramolecular Polymerizations: Switching Between Co- and Homopolymers. (2015) Chem. Eur. J. 21:3304-3309.
Weilbächer M, Allmeroth M, Hemmelmann M, Ritz S, Mailänder V, Bopp T, Barz M, Zentel R. Interaction of N-(2-hydroxypropyl)methacrylamide based homo, random and block copolymers with primary immune cells. (2014) J Biomed Nanotechnol. 10:81–91.
In einem humanisierten Mausmodell des malignen Melanoms soll Tumorgewebe über das Targeting inhibitorischer Zellpopulationen adressiert und moduliert werden. pH-responsive Liposomen aus der vorigen Förderperiode werden zu smarten, programmierbaren Liposomen mit zeitlich programmierbarer Freisetzung und pH-modulierenden Eigenschaften weiterentwickelt, um Wirkstoffe zum Eingriff in die Signalsteuerung von vor allem Makrophagen, regulatorische T-Zellen (Treg) und Tumorzellen gezielt freizusetzen und mit einer pH-Modulation des Tumormikromilieus zu verbinden.
M. Helm, A. Tüttenberg, A. Walther
Projektrelevante Publikationenseit 2017:
Jonathan Schupp, Arne Christians, Niklas Zimmer, Lukas Gleue, Helmut Jonuleit, Mark Helm and Andrea Tuettenberg. In depth immune-oncology studies of the tumor microenvironment in a humanized melanoma mouse model. In press, IJMS 2021.
Krebs FK, Trzeciak E, Zimmer S, Oezistanbullu D, Mitzel-Rink H, Meissner M, Grabbe S, Loquai C, Tuettenberg A. Immune signature as predictive marker for response to checkpoint inhibitor immunotherapy and overall survival in melanoma. Cancer Med. (2021). DOI:10.1002/cam4.3710.
Zimmer N, Krebs FK, Zimmer S, Mitzel-Rink H, Kumm EJ, Jurk K, Grabbe S, Loquai C, Tuettenberg A. Platelet-Derived GARP Induces Peripheral Regulatory T Cells-Potential Impact on T Cell Suppression in Patients with Melanoma-Associated Thrombocytosis. Cancers (Basel). (2020) Dec 5;12(12):3653. doi: 10.3390/cancers12123653.
Schupp J, Krebs FK, Zimmer N, Trzeciak E, Schuppan D, Tuettenberg A. Targeting myeloid cells in the tumor sustaining microenvironment. (2019) Cell Immunol. 343:103713.
Zimmer N, Kim E, Sprang B, Leukel P, Khafaji F, Ringel F, Sommer C, Tuettenberg J, Tuettenberg A. GARP as an immune regulatory molecule in the tumormicroenvironment of glioblastoma multiforme. (2019) Int J Mol Sci. 20: 3676.
Weber C, Voigt M, Simon J, Danner AK, Frey H, Mailänder V, Helm M, Morsbach S, Landfester K. Functionalization of Liposomes with Hydrophilic Polymers Results in Macrophage Uptake Independent of the Protein Corona. (2019) Biomacromolecules. 20:2989-2999.
Leber N, Kaps L, Aslam M, Schupp J, Brose A, Schäffel D, Fischer K, Diken M, Strand D, Koynov K, Tuettenberg A, Nuhn L, Zentel R, Schuppan D. SiRNA-mediated in vivo gene knockdown by acid-degradable cationic nanohydrogel particles. (2017) J Control Release. 248:10-23.
Heinen L, Heuser T, Steinschulte A, Walther A. Antagonistic Enzymes in a Biocatalytic pH Feedback System Program Autonomous DNA Hydrogel Life Cycles. (2017) Nano Lett. 17:4989.
Hellmuth I, Freund I, Schlöder J, Seidu-Larry S, Thüring K, Slama K, Langhanki J, Kaloyanova S, Eigenbrod T, Krumb M, Röhm S, Peneva K, Opatz T, Jonuleit H, Dalpke AH, Helm M. Bioconjugation of Small Molecules to RNA Impedes Its Recognition by Toll-Like Receptor. (2017) Front Immunol. 8:312.
Hahn SA, Neuhoff A, Landsberg J, Schupp J, Eberts D, Leukel P, Bros M, Weilbaecher M, Schuppan D, Grabbe S, Tueting T, Lennerz V, Sommer C, Jonuleit H, Tuettenberg A. A key role of GARP in the immune suppressive tumor microenvironment. (2016) Oncotarget. 7:42996-43009.
Fritz T, Voigt M, Worm M, Negwer I, Müller SS, Kettenbach K, Ross TL, Roesch F, Koynov K, Frey H, Helm M. Orthogonal Click Conjugation to the Liposomal Surface Reveals the Stability of the Lipid Anchorage as Crucial for Targeting. (2016) Chem. Eur. J. 22:11578-82.
Heuser T, Steppert AK, Molano-Lopez C, Zhu B, Walther A. A Generic Concept to Program the Time Domain of Self-Assemblies with a Self-Regulation Mechanism. (2015) Nano Lett. 15:2213.
Heuser T, Weyandt E, Walther A. Biocatalytic Feedback-Driven Temporal Programming of Self-Regulating Non-Equilibrium Peptide Hydrogels. (2015) Angew. Chem. Int. Ed. 54:13258.
Nanovakzine akkumulieren in der Leber typischerweise in Toleranz-induzierenden KC (Kupffer-Zellen) und LSEC (sinusoidale Leber-Endothelzellen). Beide Zelltypen können durch geeignete Adjuvanzien zu antigenpräsentierenden Zellen reprogrammiert werden. In B15N werden Nanovakzine entwickelt, die neben dendritischen Zellen auch KC/LSEC adressieren und aktivieren. Hierdurch sollen potente anti-Tumorantworten in der Leber und in der Haut (metastasierendes Melanom) induziert werden. Als Nanovakzine werden mit Peptid-Antigenen/Adjuvanzien beladene Protein-Nanokapseln sowie mit antigen-kodierender mRNA/Nukleinsäure-Adjuvanzien beladene Liposomen evaluiert.
M. Bros, S. Gehring, K. Landfester
Projektrelevante Publikationen seit 2017:
Cacicedo ML, Medina-Montano C, Kaps L, Kappel C, Gehring S, Bros M. Role of Liver-Mediated Tolerance in Nanoparticle-Based Tumor Therapy. (2020) Cells. 9(9):1985.
Wagener K, Bros M, Krumb M, Langhanki J, Pektor S, Worm M, Schinnerer M, Montermann E, Miederer M, Frey H, Opatz T, Rösch F. Targeting of Immune Cells with Trimannosylated Liposomes. (2020) Advanced Therapeutics. 3(6):1900185.
Paßlick D, Piradashvili K, Bamberger D, Li M, Jiang S, Strand D, R. Wich P, Landfester K, Bros M, Grabbe S, Mailänder V. Delivering all in one: Antigen-nanocapsule loaded with dual adjuvant yields superadditive effects by DC-directed T cell stimulation. (2018) Journal of Controlled Release. 289:23-34.
Shen L, Tenzer S, Storck W, Hobernik D, Raker VK, Fischer K, Decker S, Dzionek A, Krauthäuser S, Diken M, Nikolaev A, Maxeiner J, Schuster P, Kappel C, Verschoor A, Schild H, Grabbe S, Bros M. Protein corona–mediated targeting of nanocarriers to B cells allows redirection of allergic immune responses. (2018) Journal of Allergy and Clinical Immunology. 142(5):1558-1570.
Bros M, Nuhn L, Simon J, Moll L, Mailänder V, Landfester K, Grabbe S. The Protein Corona as a Confounding Variable of Nanoparticle-Mediated Targeted Vaccine Delivery. (2018) Frontiers in Immunology. 9:1760.
Fichter M, Piradashvili K, Pietrzak-Nguyen A, Pretsch L, Kuhn G, Strand S, Knuf M, Zepp F, Wurm FR, Mailänder V, Landfester K, Gehring S. Polymeric hepatitis C virus non-structural protein 5A nanocapsules induce intrahepatic antigen-specific immune responses. (2016) Biomaterials. 108:1-12.
Pietrzak-Nguyen A, Piradashvili K, Fichter M, Pretsch L, Zepp F, Wurm FR, Landfester K, Gehring S. MPLA-coated hepatitis B virus surface antigen (HBsAg) nanocapsules induce vigorous T cell responses in cord blood derived human T cells. (2016) Nanomedicine: Nanotechnology, Biology and Medicine. 12(8):2383-2394.
Piradashvili K, Fichter M, Mohr K, Gehring S, Wurm FR, Landfester K. Biodegradable Protein Nanocontainers. (2015) Biomacromolecules. 16(3):815-821.
Fichter M, Dedters M, Pietrzak-Nguyen A, Pretsch L, Meyer CU, Strand S, Zepp F, Baier G, Landfester K, Gehring S. Monophosphoryl lipid A coating of hydroxyethyl starch nanocapsules drastically increases uptake and maturation by dendritic cells while minimizing the adjuvant dosage. (2015) Vaccine. 33(7):838-846.
Pietrzak-Nguyen A, Fichter M, Dedters M, Pretsch L, Gregory SH, Meyer C, Doganci A, Diken M, Landfester K, Baier G, Gehring S. Enhanced in Vivo Targeting of Murine Nonparenchymal Liver Cells with Monophosphoryl Lipid A Functionalized Microcapsules. (2014) Biomacromolecules. 15(7):2378-2388.
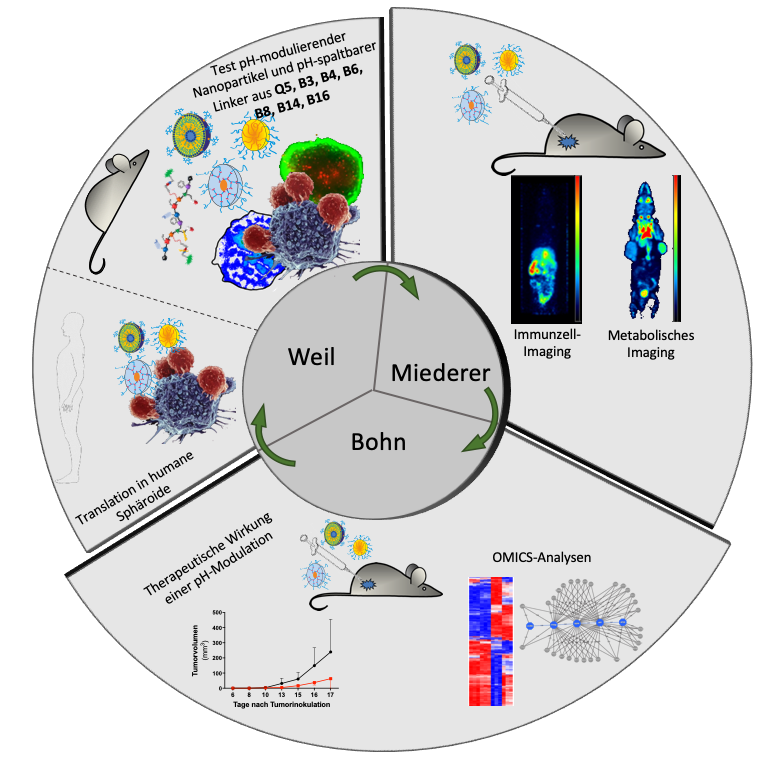
In B16N soll mithilfe pH-modulierender Nanocarrier der metabolische Status des Tumormikromilieus verändert werden. Aggressive, schnell wachsende Tumore sind durch ein saures Mikromilieu gekennzeichnet, das die Differenzierung eines nicht-inflammatorischen Makrophagen-Subtyps fördert. Die Nanocarrier-induzierte Erhöhung des pH-Werts soll mittels PET abgebildet und die resultierenden Effekte auf die tumorinfiltrierenden Immunzellen mithilfe von PET und OMICS-Analysen untersucht werden. Darüber hinaus werden aus humanen Tumorbiopsien Tumorsphäroide hergestellt und genutzt, um die pH-Wert-Modulation und ihre Auswirkungen auf die Immunzellinfiltrate auf humane Tumore translatieren zu können.
T. Bohn, M. Miederer, T. Weil
Nanopartikel werden mit CAF spezifischen Liganden (z.B. anti-PDGFRβ) oberflächen-modifiziert, mit CAF modulierenden Wirkstoffen (z.B. anti-TGFβ1 siRNA, AT1R-Antagonisten) beladen und anschließend in vitro (u.a. in Tumororganoiden) getestet, um geeignete Kandidaten für therapeutische in vivo Versuche zu selektieren. Neben Bestimmung der Körperverteilung und Tumoranreicherung der wirkstoffbeladenen Nanopartikel mit Hilfe von multimodaler Bildgebung, sollen etwaige tumorinhibierende Effekte in geeigneten murinen Lebertumormodellen untersucht werden, wobei Transkriptom- und Proteomanalysen zur Aufklärung von Wirkmechanismen beitragen sollen.
M. Diken, L. Kaps, T. Lammers
Projektrelevante Publikationen seit 2017:
May JN, Golombek SK, Baues M, Dasgupta A, Drude N, Rix A, Rommel D, Von Stillfried S, Appold L, Pola R, Pechar M, Van Bloois L, Storm G, Kuehne AJC, Gremse F, Theek B, Kiessling F, Lammers T. Multimodal and multiscale optical imaging of nanomedicine delivery across the blood-brain barrier upon sonopermeation. (2020) Theranostics. 10:1948-1959.
Wang B, Van Herck S, Chen Y, Bai X, Zhong Z, Deswarte K, Lambrecht BN, Sanders NN, Lienenklaus S, Scheeren HW, David SA, Kiessling F, Lammers T*, De Geest BG*, Shi Y*. Potent and Prolonged Innate Immune Activation by Enzyme-Responsive Imidazoquinoline TLR7/8 Agonist Prodrug Vesicles. (2020) J Am Chem Soc. 142:12133-12139.
Sun Q, Baues M, Klinkhammer BM, Ehling J, Djudjaj S, Drude NI, Daniel C, Amann K, Kramann R, Kim H, Saez-Rodriguez J, Weiskirchen R, Onthank DC, Botnar RM, Kiessling F, Floege J, Lammers T*, Boor P*. Elastin imaging enables noninvasive staging and treatment monitoring of kidney fibrosis. (2019) Sci Transl Med. 11:eaat4865.
Sun Q, Barz M, De Geest BG, Diken M, Hennink WE, Kiessling F, Lammers T*, Shi Y*. Nanomedicine and macroscale materials in immuno-oncology. (2019) Chem Soc Rev. 48:351-381.
Kaps L*, Leber N*, Yang A, Aslam M, Giardino M, Klefenz A, Choteschovsky N, Rosigkeit S, Mostafa A, Nuhn L, Schuppan D, Zentel R. α-Mannosyl-Functionalized Cationic Nanohydrogel Particles for Targeted Gene Knockdown in Immunosuppressive Macrophages. (2019) Macromol Biosci. 1900162:1900162.
van der Meel R, Sulheim E, Shi Y, Kiessling F, Mulder WJM, Lammers T. Smart cancer nanomedicine. (2019) Nat Nanotechnol. 14:1007-1017.
Kaps L*, Leber N*, Aslam M, Schupp J, Brose A, Schäffel D, Fischer K, Diken M, Strand D, Koynov K, Tuettenberg A, Nuhn L, Zentel R, Schuppan D. SiRNA-mediated in vivo gene knockdown by acid-degradable cationic nanohydrogel particles. (2017) J Control Release. 248:10-23.
Sahin U, Derhovanessian E, Miller M, Kloke BP, Simon P, Löwer M, Bukur V, Tadmor AD, Luxemburger U, Schrörs B, Omokoko T, Vormehr M, Albrecht C, Paruzynski A, Kuhn AN, Buck J, Heesch S, Schreeb KH, Müller F, Ortseifer I, Vogler I, Godehardt E, Attig S, Rae R, Breitkreuz A, Tolliver C, Suchan M, Martic G, Hohberger A, Sorn P, Diekmann J, Ciesla J, Waksmann O, Brück AK, Witt M, Zillgen M, Rothermel A, Kasemann B, Langer D, Bolte S, Diken M, Kreiter S, Nemecek R, Gebhardt C, Grabbe S, Höller C, Utikal J, Huber C, Loquai C, Türeci Ö. Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. (2017) Nature. 547:222-226.
Diken M, Vormehr M, Grunwitz C, Kreiter S, Türeci Ö, Sahin U. Discovery and subtyping of neo-epitope specific T-cell responses for cancer immunotherapy: Addressing the mutanome. In: Methods in Molecular Biology. Vol 1499. (2017) Humana Press Inc. 223-236.
Kaps L*, Nuhn L*, Aslam M, Brose A, Foerster F, Rosigkeit S, Renz P, Heck R, Kim YO, Lieberwirth I, Schuppan D, Zentel R. In Vivo Gene-Silencing in Fibrotic Liver by siRNA-Loaded Cationic Nanohydrogel Particles. (2015) Adv Healthc Mater. 4:2809-2815
*Geteilte Autorenschaft
Ziel des TP B18N ist die pharmazeutische, präklinische und klinische Entwicklung einer neuartigen, nanopartikulären Vakzineplattform zur Behandlung von Patienten mit Polyomvirus-assoziiertem Merkelzellkarzinom (PyV-MCC). Hierzu wird das patentierte transkutane Impfverfahren in eine geeignete nanopartikuläre Applikationsform entwickelt, um damit Verträglichkeit und Wirksamkeit in einem Polyomvirus-induzierten Tumormodell zu testen und die Wirkmechanismen zu analysieren. Zudem sollen die formalen Voraussetzungen geschaffen und umgesetzt werden, um eine klinische Prüfung bei PyV-MCC-Patienten vorzunehmen.
P. Langguth, M. Radsak, S. Grabbe
Projektrelevante Publikationen seit 2017:
Pielenhofer J, Sohl J, Windbergs M, Langguth P, Radsak MP. Current Progress in Particle-Based Systems for Transdermal Vaccine Delivery. (2020) Front Immunol. 11:266.
Sahin U, Oehm P, Derhovanessian E, Jabulowsky RA, Vormehr M, Gold M, Maurus D, Schwarck-Kokarakis D, Kuhn AN, Omokoko T, Kranz LM, Diken M, Kreiter S, Haas H, Attig S, Rae R, Cuk K, Kemmer-Brück A, Breitkreuz A, Tolliver C, Caspar J, Quinkhardt J, Hebich L, Stein M, Hohberger A, Vogler I, Liebig I, Renken S, Sikorski J, Leierer M, Müller V, Mitzel-Rink H, Miederer M, Huber C, Grabbe S, Utikal J, Pinter A, Kaufmann R, Hassel JC, Loquai C, Türeci Ö. An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma. (2020) Nature. 585(7823):107-112.
Bialojan A, Sohl J, Rausch J, Aranda Lopez P, Denny M, Langguth P, Hartmann AK, Yagita H, Probst HC, Schild H, Radsak MP. Transcutaneous immunization with CD40 ligation boosts cytotoxic T lymphocyte mediated antitumor immunity independent of CD4 helper cells in mice. (2019) Eur. J Immunol. 49(11):2083-2094.
Teschner D, Cholaszczyńska A, Ries F, Beckert H, Theobald M, Grabbe S, Radsak MP, Bros M. (2019) CD11b regulates fungal outgrowth but not neutrophil recruitment in a mouse model of invasive pulmonary aspergillosis. (2019) Front. Immunol. 10:123.
Rausch J, Lopez PA, Bialojan A, Denny M, Langguth P, Probst HC, Schild H, Radsak MP. Combined immunotherapy: CTLA-4 blockade potentiates anti-tumor response induced by transcutaneous immunization. (2017) J. Dermatol. Sci. 87(3):300-306.
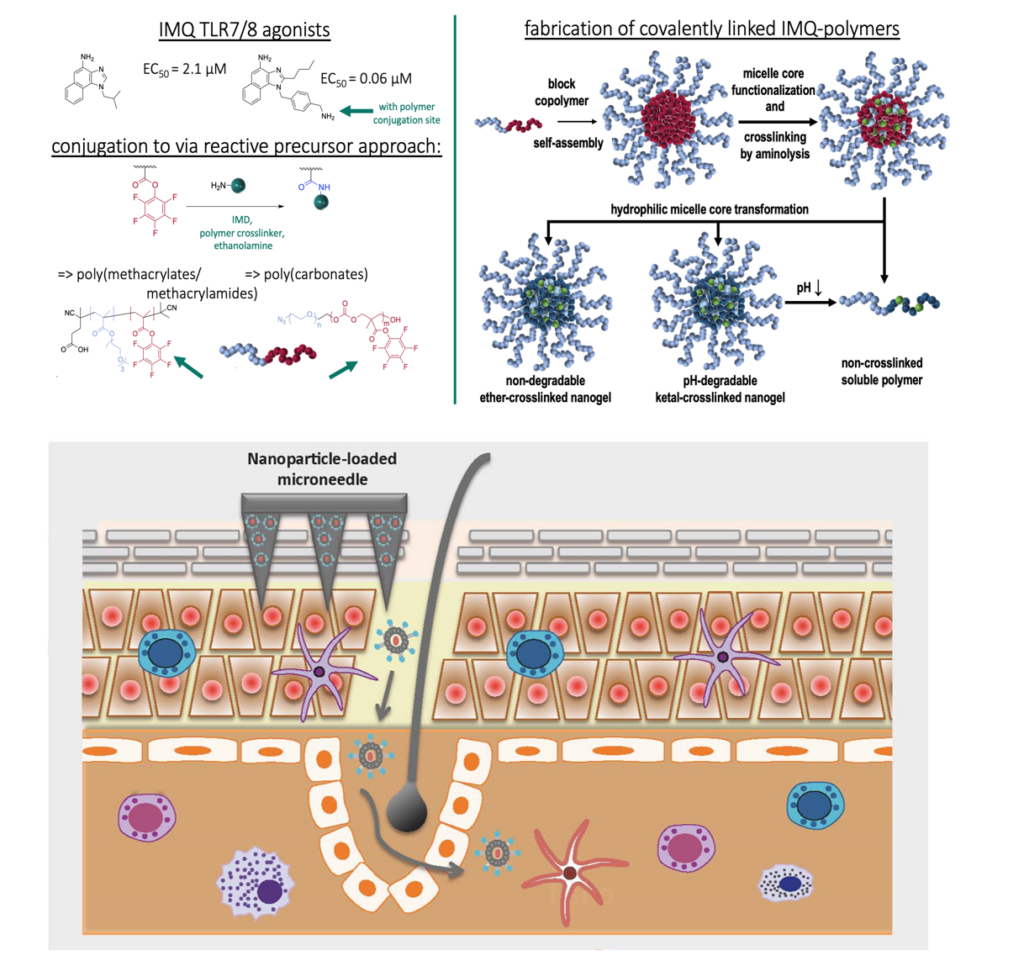
Lopez PA, Denny M, Hartmann AK, Alflen A, Probst HC, von Stebut E, Tenzer S, Schild H, Stassen M, Langguth P, Radsak MP. Transcutaneous immunization with a novel imiquimod nanoemulsion induces superior T cell responses and virus protection. (2017) J. Dermatol. Sci. 87(3):252-259.